یک تعریف عمومی از خوردگی، تخریب یک ماده از طریق تعامل زیست محیطی است. این تعریف همه مواد را در بر می گیرد، چه مواد طبیعی و چه ساخته دست بشر که شامل پلاستیک، سرامیک و فلزات می باشد.
چرا فلزات خورده می شوند؟
پاسخ در علم ترمودینامیک نهفته است، که می گوید آیا فرآیندی مانند خوردگی رخ خواهد داد یا خیر. دومین سوال منطقی این است که سرعت خوردگی چقدر است؟یا یک خط لوله چقدر طول می کشد تا خورده شود ؟
سینتیک خوردگی می تواند به ارائه پاسخ به این سوال کمک کند.
هنگامی که فلز از سنگ معدن استخراج می شود، مقدار قابل توجهی انرژی به فلز وارد می شود و آن را در حالت پر انرژی قرار می دهد. این سنگها معمولاً اکسیدهای فلزی مانند هماتیت (Fe2O3) برای فولاد یا بوکسیت (Al2O3 . H2O) برای آلومینیوم هستند. یکی از اصول ترمودینامیک این است که یک ماده همیشه به دنبال پایین ترین حالت انرژی است. به عبارت دیگر، بیشتر فلزات از نظر ترمودینامیکی ناپایدار هستند و به دنبال حالت انرژی کمتری هستند که یک اکسید یا ترکیب دیگری است. فرآیندی که طی آن فلزات به اکسیدهای کم انرژی تبدیل می شوند، خوردگی نامیده می شود.
خوردگی رایج ترین مواد مهندسی در دماهای نزدیک به محیط در محیط های آبی (حاوی آب) اتفاق می افتد و ماهیت الکتروشیمیایی دارد. محیط آبی به عنوان الکترولیت نیز شناخته می شود و در مورد خوردگی زیرزمینی، خاک مرطوب است. فرآیند خوردگی شامل حذف الکترونها (اکسیداسیون) فلز [معادله (1)] و مصرف آن الکترونها توسط برخی واکنشهای احیا دیگر، مانند احیا اکسیژن یا آب است (معادلات (2) و (3) به ترتیب)

واکنش اکسیداسیون را معمولاً واکنش آندی و واکنش احیا را واکنش کاتدی می نامند. هر دو واکنش الکتروشیمیایی برای وقوع خوردگی ضروری هستند.
واکنش اکسیداسیون باعث از دست دادن فلز واقعی می شود، اما واکنش احیا باید وجود داشته باشد تا الکترون های آزاد شده توسط واکنش اکسیداسیون مصرف شود و خنثی بودن بار حفظ شود. در غیر این صورت، یک بار منفی بزرگ به سرعت بین فلز و الکترولیت ایجاد می شود و فرآیند خوردگی متوقف می شود.
واکنشهای اکسیداسیون و احیا گاهی اوقات به عنوان واکنشهای نیم سلولی شناخته میشوند و میتوانند به صورت موضعی (در همان محل روی فلز) رخ دهند یا به صورت فیزیکی از هم جدا شوند.
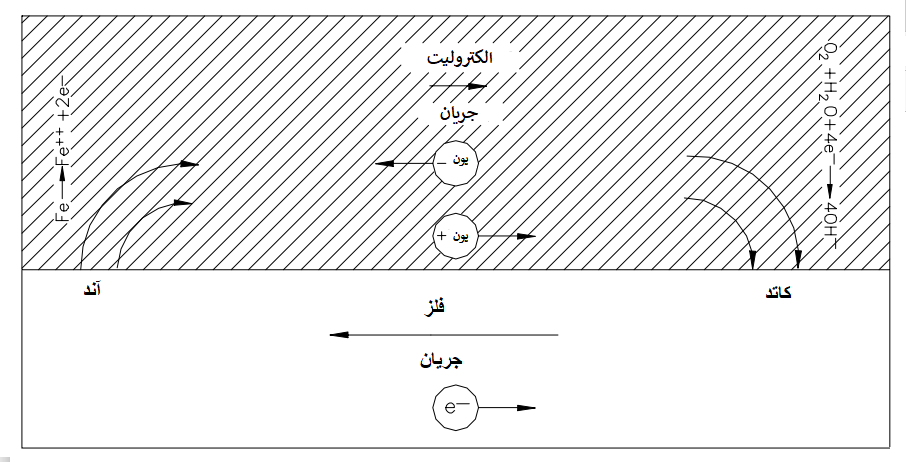
هنگامی که واکنش های الکتروشیمیایی به طور فیزیکی از هم جدا می شوند، این فرآیند ، سلول خوردگی تفاضلی نامیده می شود. شماتیک یک سلول خوردگی تفاضلی در شکل 1.1 آورده شده است. محلی که در آن فلز در حال اکسید شدن است، آند یا سایت آندی نامیده می شود. در این مکان، جریان الکتریکی مستقیم (که به عنوان یک جریان بار مثبت تعریف می شود) از سطح فلز به الکترولیت می رود، زیرا یون های فلزی از سطح خارج می شوند. این جریان در الکترولیت به محلی که اکسیژن، آب یا برخی از گونه های دیگر در آن کاهش می یابد جریان می یابد. این سایت به عنوان سایت کاتد یا کاتدیک شناخته می شود. چهار جزء ضروری یک سلول خوردگی تفاضلی وجود دارد.
- آند بایستی حتما وجود داشته باشد.
- کاتد باید وجود داشته باشد
- یک مسیر فلزی نیز بایستی وجود داشته باشد که به طور الکتریکی آند و کاتد را به هم متصل می کند. (به طور معمول، این خود خط لوله خواهد بود.)
- آند و کاتد باید در یک الکترولیت رسانای الکتریکی (به طور معمول، خاک مرطوب) غوطه ور شوند.
خوردگی زیرزمینی خطوط لوله و سایر سازه ها اغلب نتیجه سلول های خوردگی تفاضلی است که انواع مختلفی از آن ها وجود دارد. این ها شامل سلول های هوادهی تفاضلی است که در آن قسمت های مختلف لوله در معرض غلظت های مختلف اکسیژن در خاک قرار می گیرند و سلول ها توسط تفاوت در ماهیت سطح لوله یا شیمی خاک ایجاد می شوند. خوردگی گالوانیکی شکلی از سلول خوردگی تفاضلی است که در آن دو فلز مختلف به صورت الکتریکی جفت شده و در یک محیط خورنده قرار می گیرند.
چگونه خوردگی را تشخیص می دهیم؟
ماهیت الکتروشیمیایی فرآیند خوردگی فرصت هایی را برای شناسایی و کاهش خوردگی سازه های زیرزمینی فراهم می کند. ما می توانیم ولتاژها و جریان های مرتبط با فرآیند خوردگی را بررسی کنیم.
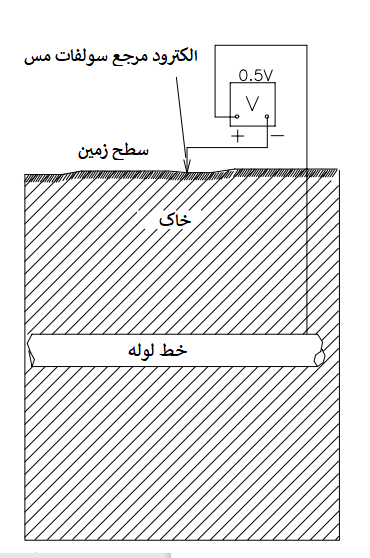
هنگامی که یک قطعه فلز در یک الکترولیت، مانند خاک، قرار می گیرد، به دلیل ماهیت الکتروشیمیایی فرآیند خوردگی، ولتاژی در سطح مشترک فلز-الکترولیت ایجاد می شود. ما نمیتوانیم این ولتاژ را مستقیماً اندازهگیری کنیم، اما با استفاده از یک ولت متر، میتوانیم ولتاژ بین دو فلز مختلف را که در خاک قرار میگیرند اندازهگیری کنیم. ما همچنین می توانیم اختلاف پتانسیل بین یک فلز و یک الکترود مرجع را که معمولاً الکترود نیم سلولی نامیده می شود، اندازه گیری کنیم. این ولتاژ به عنوان یک پتانسیل خوردگی، یک پتانسیل مدار باز، یا یک پتانسیل محلی برای آن فلز در محیطی که اندازه گیری در آن انجام می شود، نامیده می شود. برای محیط های خاک، رایج ترین الکترود مرجع مورد استفاده، الکترود مرجع سولفات مس- مس (CSE) است.
اندازه گیری های پتانسیل را می توان برای برآورد مقاومت نسبی فلزات مختلف در برابر خوردگی در یک محیط معین استفاده کرد. فلزات نجیب مانند طلا و پلاتین پتانسیل مثبت بیشتری دارند و در برابر خوردگی مقاومت بیشتری نسبت به فلزات مهندسی رایج مانند فولاد و آلومینیوم از خود نشان می دهند.
سری گالوانیکی فهرستی از فلزات و آلیاژها است که بر اساس پتانسیل خوردگی نسبی آنها در یک محیط معین مرتب شده اند. جدول زیر یک سری گالوانیکی برای فلزات و سایر مواد در حالت خنثی نشان می دهد. خاک و آب، نشان می دهد که کربن دارای بیشترین پتانسیل مثبت در بین مواد ذکر شده و منیزیم دارای بیشترین پتانسیل منفی است. پتانسیل های اندازه گیری شده برای فلزات مختلف در یک سری گالوانیکی بسته به ماهیت آن تا حدودی متفاوت است. اما موقعیت نسبی فلزات برای محیط های طبیعی مانند خاک و آب دریا مشابه است.
یکی دیگر از کاربردهای اندازه گیری پتانسیل خوردگی، تعیین احتمال وقوع خوردگی گالوانیکی است. هنگامی که دو فلز در یک محیط به صورت الکتریکی جفت می شوند، عضو منفی (فعال) زوج به آند در سلول خوردگی تفاضلی تبدیل می شود و عضو مثبت (نجیب) زوج به کاتد در سلول تبدیل می شود. به طور کلی، شدت جفت گالوانیکی با افزایش اختلاف پتانسیل بین دو عضو زوج افزایش می یابد، اگرچه همیشه اینطور نیست. سری گالوانیکی نشان داده شده در جدول 1.1 نشان می دهد که در جایی که مس به صورت الکتریکی به فولاد ملایم در خاک کوپل شده است، مس به کاتد و فولاد به آند تبدیل می شود و خوردگی فولاد را تسریع می کند.
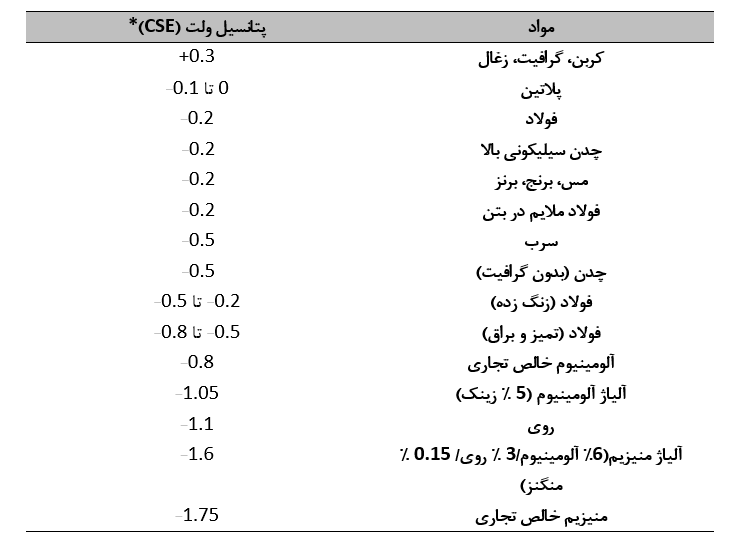
جدول بالا همچنین نشان می دهد که پتانسیل فولاد مرطوب بسته به تمیز بودن سطح یا پوشیده شدن با درجه سند بلاست می تواند متفاوت باشد. پتانسیل فولاد نیز تابعی از خواص خاک از جمله pH، غلظت یون، اکسیژن و رطوبت است. تفاوتهای بالقوهای که در خطوط لوله زیرزمینی و سایر سازهها در نتیجه این عوامل ایجاد میشود، میتواند منجر به خوردگی شدید شود. بحث های بیشتر در مورد این سلول های خوردگی تفاضلی در فصل 16 آورده شده است.
اندازهگیریهای پتانسیل معمولاً در خطوط لوله زیرزمینی برای تشخیص وجود این نوع سلولهای خوردگی تفاضلی استفاده میشوند. یک اتصال الکتریکی به لوله ایجاد می شود و پتانسیل لوله با توجه به الکترود مرجع قرار داده شده روی لوله اندازه گیری می شود. این فرآیند به صورت شماتیک در شکل زیر نشان داده شده است. به طور معمول، الکترود مرجع به سرب منفی یک ولت متر دیجیتال متصل می شود تا قرائت منفی بدست آید. همان طور که در جدول بالا نشان داده شده است، اکثر پتانسیل ها در خاک منفی هستند. با این نوع اندازه گیری، منفی ترین نواحی سازه آندها هستند و به دلیل وجود سلول های خوردگی تفاضلی، دچار خوردگی تسریع شده می شوند.
اگر آندها و کاتدها بزرگ باشند، می توان از اندازه گیری های فعلی برای تشخیص سلول های خوردگی تفاضلی استفاده کرد. این سلولهای بزرگ جریانهای بزرگی ایجاد میکنند که با اندازهگیریهای انجامشده روی لوله یا سایر سازههای زیرزمینی ، از طریق قانون اهم V =IR، که در آن V ولتاژ، I جریان، و R مقاومت است) قابل تشخیص هستند . میدانیم که جریان در خاک یک گرادیان ولتاژ ایجاد میکند. این گرادیان را می توان با قرار دادن الکترودهای مرجع یکسان روی لوله و اندازه گیری آن تشخیص داد.
اندازه گیری ولتاژ را می توان برای نشان دادن جهت جریان سلول تفاضلی استفاده کرد. مکان های آندی و کاتدی روی خط لوله را می توان با انجام یک سری از اندازه گیری های پتانسیل سلول به سلول که در طول خط لوله انجام می شود، تعیین کرد.
یکی دیگر از منابع احتمالی جریان در زمین، جریان های سرگردان است.
چگونه خوردگی را کاهش دهیم؟
روش های اصلی برای کاهش خوردگی در خطوط لوله زیرزمینی، پوشش ها و حفاظت کاتدی CP است. اگرچه در فصل های بعدی با جزئیات بیشتری به هر یک پرداخته می شود، این دو روش در این جا به اختصار توضیح داده می شوند.
پوششها معمولاً برای تشکیل یک لایه پیوسته از یک ماده عایق الکتریکی بر روی سطح فلزی حفاظت شده استفاده می شوند. اساس و عملکرد چنین پوششی جداسازی فلز از تماس مستقیم با الکترولیت اطراف است و برای ایجاد یک مقاومت الکتریکی بالا استفاده می شود که واکنش های الکتروشیمیایی به راحتی انجام نشود. در حقیقت، تمام پوششها، صرف نظر از کیفیت کلی، دارای حفرههایی هستند که به آن ها منفذ گفته میشود، که در حین استفاده، یا در حین حمل و نقل یا نصب لولههای پوشش داده شده، ایجاد میشوند. منافذ در پوششها نیز در نتیجه تخریب پوشش، تنشهای خاک یا حرکت لوله در زمین ایجاد میشود. تخریب پوشش در سرویس نیز می تواند منجر به جدا شدن از سطح لوله شود و فلز را بیشتر در معرض محیط خورنده زیرزمینی قرار دهد. نرخ خوردگی بالا در منافذ یا در یک منطقه جدا شده می تواند منجر به نشتی یا پارگی شود، حتی در جایی که پوشش به طور موثر درصد بالایی از سطح لوله را محافظت می کند. بنابراین، پوشش ها به ندرت در خطوط لوله زیرزمینی در غیاب حفاظت کاتدی (CP) استفاده می شوند. عملکرد اصلی یک پوشش روی لوله های محافظت شده کاتدی، کاهش سطح فلز در معرض روی خط لوله است، در نتیجه جریان لازم برای حفاظت کاتدی فلز را کاهش می دهد.









